Границы | Раскрыть тайны сывороточного альбумина - больше, чем просто сывороточный белок | физиология
- Сывороточный альбумин Состав
- функция
- распределение
- Накопление альбумина в интерстиции опухоли
- Клеточные альбумин-связывающие белки
- Albondin / GP60
- gp18 и gp30
- SPARC
- ВПЧ и кальретикулин
- FcRn
- Кубилин и Мегалин
- Альбумин как лекарственный препарат в онкологии
- Заключение
- Заявление о конфликте интересов
- Подтверждения
Сывороточный альбумин Состав
Сывороточный альбумин является наиболее распространенным белком в плазме крови всех позвоночных животных с концентрацией в сыворотке крови человека 35–50 мг / мл ( Петерс, 1996 ). Человеческий сывороточный альбумин (HSA) имеет молекулярную массу 66 348 Да и состоит из трех гомологичных доменов, пронумерованных I, II и III (рисунок 1 ) ( Он и Картер, 1992 ; Петерс, 1996 ; Сугио и др., 1999 ). Каждый домен сгруппирован в подобласти A и B, которые обладают общими структурными мотивами. Две основные области, ответственные за связывание лиганда с HSA, известны как сайты I и II Судлоу, расположенные в поддомене IIA и IIIA (рис. 1 ) соответственно ( Судлоу и др., 1976 ; Петерс, 1996 ). Альбумин кодируется одним геном, который экспрессируется совместно доминантно, причем оба аллеля транскрибируются и транслируются ( Хокинс и Дугайчик, 1982 ; Петерс, 1996 ). Ген человеческого альбумина расположен на длинном плече хромосомы 4 в положении q13.3.

Рис. 1. Структура сывороточного альбумина человека, состоящего из трех доменов, каждый из которых сгруппирован в субдомены A и B (субдомен Ia, желтый; Ib, зеленый; IIa, красный; IIb, пурпурный; IIIa, синий; и IIIb, голубой) . Sugio et al. (1999) с разрешения издательства Оксфордского университета.
функция
Альбумин в основном синтезируется печенью, при этом печень человека производит ~ 13,9 г ЧСА в день ( Петерс, 1996 ). HSA имеет приблизительный период полураспада 19 дней и ухудшается более эффективно, если он денатурирован или структурно изменен ( Петерс, 1996 ). Альбумин выполняет множество важных функций и отвечает за 80% коллоидного осмотического давления крови ( Петерс, 1996 ). Важно отметить, что альбумин способен связывать различные эндогенные молекулы, включая длинноцепочечные жирные кислоты, стероиды, L-триптофан и т. Д. ( Краг-Хансен, 1981 ; Петерс, 1996 ; Эванс, 2002 ). Кроме того, альбумин также участвует в транспортировке ионов в кровообращение, в том числе меди, цинка, кальция и т. Д. ( Петерс, 1996 ).
Кроме того, этот жизненно важный белок способен связывать экзогенные соединения и лекарства, такие как варфарин, ибупрофен, хлорпромазин и напроксен, сродство их связывания значительно влияет на их активность и период полураспада ( Краг-Хансен, 1981 ; Петерс, 1996 ; Эванс, 2002 ). Кроме того, альбумин также действует как носитель токсичных отходов, связывая билирубин, продукт расщепления гема, доставляя его в печень для выведения из печени ( Петерс, 1996 ). Интересно, что альбумин также считается антиоксидантом благодаря своей способности: (1) защищать связанные вещества от перекисного повреждения (например, жирные кислоты и липопротеины); и (2) связывают свободную медь, ограничивая ее окислительно-восстановительную активность и образование свободных радикалов ( Петерс, 1996 ; Эванс, 2002 ). Наконец, альбумин является источником тиолов, которые являются активными акцепторами кислорода и азота ( Петерс, 1996 ; Эванс, 2002 ).
распределение
Интересно, что альбумин преимущественно присутствует во внесосудистом пространстве (~ 242 г), а не внутрисосудистом пространстве (~ 118 г) ( Петерс, 1996 ; Эванс, 2002 ). Фактически, белок преобладает во внеклеточных местах, таких как кожа, кишечник, мышцы, другие жидкости (например, спинномозговая, плевральная и т. Д.) И секретах (например, пот, слезы и молоко) ( Петерс, 1996 ). Однако внутриклеточно присутствуют очень низкие концентрации альбумина ( Петерс, 1996 ). Альбумин возвращается из внесосудистого пространства в кровообращение через лимфатическую систему, совершая ~ 28 «попыток» входа и выхода из лимфатической системы в течение всей жизни ( Петерс, 1996 ; Эванс, 2002 ).
При секреции из гепатоцитов альбумин попадает в кровообращение и перемещается во внеклеточное пространство через поры синусоидального или фенестрированного эндотелия в определенных органах, таких как печень, поджелудочная железа, тонкий кишечник и костный мозг ( Петерс, 1996 ). Однако в органах, где преобладает непрерывный эндотелий, в настоящее время считается, что альбумин может проходить через эндотелий посредством активных трансцитотических механизмов, включая механизмы, опосредованные рецепторами (например, альбондин; см. Раздел, озаглавленный «Белки, связывающие клеточный альбумин»).
Накопление альбумина в интерстиции опухоли
Солидные опухоли обычно обладают незрелой, высокопроницаемой сосудистой сетью, на которую воздействуют факторы, увеличивающие проницаемость сосудов (например, оксид азота) ( Carmeliet and Jain, 2000 ; Маэда и др., 2000 ; Greish, 2007 ; Ван дер Вельдт и др., 2008 ). Однако, несмотря на это, как правило, недостаточный лимфодренаж ( Carmeliet and Jain, 2000 ; Маэда и др., 2000 ; Greish, 2007 ). Это впоследствии приводит к накоплению макромолекул (> 40 кДа) в интерстиции опухоли, и это известно как усиленный эффект проникновения и удержания (рис. 2 ) ( Маэда и др., 2000 ; Greish, 2007 ). Представляет интерес, Мацумура и Маэда (1986) продемонстрировали, что внутривенно введенный комплекс синего альбумина Эванса накапливался в саркоме 180 опухолей у мышей ddY. Задержка альбумина в опухолях с тех пор наблюдалась в различных экспериментальных солидных опухолях (например, саркоме, раке яичника, гепатоме Новикофа и т. Д.) С использованием сывороточного альбумина с радиоактивной меткой или красителем ( Петерсон и Аппельгрен, 1973 ; Синн и др., 1990 ; Андерссон и др., 1991 ; Шиллинг и др., 1992 ; Стеле и др., 1997 ; Вундер и др., 1997 ).
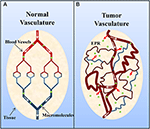
Фигура 2. Схематическое изображение (А) нормальной и (В) сосудистой системы опухоли . Нормальная ткань состоит из зрелых, организованных кровеносных сосудов, а опухолевая ткань состоит из незрелых, протекающих и извилистых сосудов. Измененная организация сосудистой сети опухоли и дезорганизованной лимфатической сети приводит к утечке сосудов и накоплению макромолекул (> 40 кДа) в интерстиции и известна как эффект усиленного проникновения и удержания (EPR). Адаптировано с разрешения Macmillan Publishers Ltd: Медицина Природы ( Джайн, 2001 ), авторское право (2001).
Кроме того, в ряде исследований было высказано предположение, что опухоли являются местом катаболизма альбумина ( Градец, 1958 ; Андерссон и др., 1991 ; Шиллинг и др., 1992 ; Стеле и др., 1997 ). Например, в мышиной модели саркомы (C57 / RL6J), инъецированной меченным 3H-рафинозой альбумином, по меньшей мере в 2–3 раза более высокие уровни 3H наблюдались в лизосомах опухолей по сравнению с лизосомами нормальной ткани ( Андерссон и др., 1991 ). Кроме того, исследования показали, что альбумин имеет более короткий период полураспада и более высокий оборот у мышей с опухолями, несмотря на компенсаторное увеличение синтеза печеночного альбумина, по сравнению с мышами, не имеющими опухолей ( Градец, 1958 ). Следовательно, было высказано предположение, что опухоли используют альбумин в качестве источника энергии, расщепляя альбумин на составляющие его аминокислоты в лизосомах, которые впоследствии используются раковыми клетками для их ускоренного роста ( Стеле и др., 1997 ). Более того, исследования показали, что гипоальбуминиемия, наблюдаемая у больных раком, является результатом катаболизма альбумина опухолью ( Стеле и др., 1997 ).
Тем не менее, некоторые из этих ранних исследований страдают от нескольких экспериментальных ограничений. Например, трудно получить чистые лизосомальные фракции, и, следовательно, необходимо воспроизвести эти исследования и проверить чистоту фракций с использованием хорошо установленных мембранных и органелл-маркеров ( Грэм, 2002 ; Ямагиши и др., 2013 ). Кроме того, некоторые другие факторы in vivo могут влиять на деградацию альбумина и катаболизм (например, уровень кортикостероидов) ( Петерс, 1996 ). Таким образом, четкая взаимосвязь не была установлена, и необходимы дополнительные исследования in vivo для поддержки внутриклеточного распределения и катаболизма альбумина опухолями.
Совсем недавно Commisso et al. обнаружили, что раковые клетки, несущие эндогенные онкогенные мутации Ras, имеют повышенный уровень макропиноцитоза in vitro и in vivo ( Commisso et al., 2013 ). Кроме того, было продемонстрировано, что FITC-меченный альбумин интернализуется через макропиноцитоз и впоследствии приводит к повышению уровня глутамата и α-кетоглутарата в онкогенных Ras-трансформированных клетках ( Commisso et al., 2013 ). Интересно отметить, что уменьшение пролиферации онкогенных Ras-экспрессирующих клеток после депривации глютамина было показано, что было достигнуто с помощью внеклеточных добавок альбумина ( Commisso et al., 2013 ). Эти результаты показывают, что макропиноцитоз альбумина обеспечивает питательные вещества для поддержания пролиферации раковых клеток ( Commisso et al., 2013 ).
Клеточные альбумин-связывающие белки
Учитывая важность альбумина, ряд предполагаемых альбумин-связывающих белков и рецепторов был идентифицирован в различных тканях и клеточных линиях (таблица 1 ), включая почки ( Zhai et al., 2000 ; Amsellem et al., 2010 ), эндотелий ( Шницер и Браво, 1993 ), фибробласты ( Портер и др., 1995 ) и поверхности опухолевых клеток ( Фрицше и др., 2004 ). В частности, было обнаружено семь мембраносвязанных альбумин-связывающих белков, а именно: альбондин / гликопротеин 60 (gp60) ( Шницер и др., 1988 ), гликопротеин 18 (gp18) ( Ghinea et al., 1988 ), гликопротеин 30 (gp30) ( Ghinea et al., 1988 ), Fc-рецептор новорожденного (FcRn) ( Рупенян и Акилеш, 2007 ) гетерогенные ядерные рибонуклеопротеины (hnRNPs) ( Фрицше и др., 2004 ), кальретикулин ( Фрицше и др., 2004 ), кубилин ( Zhai et al., 2000 ; Amsellem et al., 2010 ) и мегалин ( Zhai et al., 2000 ; Amsellem et al., 2010 ). Кроме того, был идентифицирован секретируемый альбумин-связывающий белок, известный как секретированный белок, кислый и богатый цистеином (SPARC) ( Шницер и О, 1992 ). Учитывая их важность в поглощении альбумина клетками, каждый из этих белков подробно описан ниже.

Таблица 1. Локализация альбумин-связывающих белков и рецепторов .
Albondin / GP60
Альбондин (gp60) представляет собой гликопротеин 60 кДа, который действует как рецептор альбумина, который широко распространен, но избирательно экспрессируется на плазматической мембране непрерывного эндотелия (за исключением мозга), где он действует для увеличения проницаемости капилляров ( Ghinea et al., 1988 , 1989 ; Шницер и др., 1988 ; Шницер, 1992 ; Шницер и О, 1994 ; Тируппати и др., 1996 ). Альбондин не только специфически связывает нативный альбумин, но и способствует его интернализации и последующему трансцитозу ( Миличи и др., 1987 ; Шницер, 1992 ; Шницер и О, 1994 ; Тируппати и др., 1996 ).
Было высказано предположение, что ~ 50% альбумина покидает капиллярный просвет через альбондин, а остальная часть проходит через этот барьер через межклеточные соединения и / или механизмы жидкой фазы ( Шницер, 1993 ; Шницер и О, 1994 ). Более того, было продемонстрировано, что интернализация альбондина происходит посредством кавеолин-зависимого эндоцитотического процесса, который приводит к трансцитозу и, по-видимому, не проникает в систему деградации эндосома-лизосома ( Шницер, 1993 ; Шницер и Браво, 1993 ; Шницер и др., 1995 ; Тируппати и др., 1997 ; Янку и др., 2011 ).
gp18 и gp30
Как gp18, так и gp30 активно связывают конформационно-модифицированный альбумин (то есть альбумин, меченный золотом, альбумин, обработанный формальдегидом или малеиновым ангидридом) и не взаимодействуют преимущественно с нативным альбумином, подобно другим известным рецепторам-мусорщикам ( Ghinea et al., 1989 ; Шницер и О, 1992 , 1994 ; Шницер и др., 1992 ; Шницер и Браво, 1993 ). В отличие от альбондина, gp18 и gp30 обнаруживаются в различных клетках, таких как макрофаги и фибробласты, а также в ряде эндотелий ( Шницер и др., 1992 ). Более того, было обнаружено, что gp18 экспрессируется в клетках рака молочной железы человека MDA-MB-453 ( Ван и др., 1994 ). Эти рецепторы мусорщика связывают и направляют модифицированные альбумины для деградации, возможно, как часть катаболизма белка или в качестве защитного пути для удаления измененных, старых, поврежденных или потенциально вредных альбуминов ( Шницер, 1993 ; Шницер и Браво, 1993 ). Альбумин может быть модифицирован путем окисления, неферментативного гликирования, малилирования и т. Д. В результате нормального старения или в качестве защитного или патологического ответа ( Шницер, 1993 ; Петерс, 1996 ). Денатурированный или модифицированный альбумин разлагается быстрее и эффективнее, чем нативный альбумин, что позволяет предположить, что эти изменения отбирают молекулы альбумина для деградации ( Петерс, 1996 ).
SPARC
SPARC также известен как остеонектин и BM-40 и секретируется несколькими типами клеток ( Бреккен и Мудрец, 2001 ). Интересно, что SPARC, как было установлено, высоко экспрессируется в злокачественных клетках и стромальных клетках, связанных с неоплазией ( Портер и др., 1995 ; Подхайсер и др., 2008 ). SPARC обладает альбумин-связывающими свойствами и специфически взаимодействует с нативным альбумином аналогично альбондинам, но отличается от 18 до gp30, которые связывают конформационно измененный альбумин ( Шницер и О, 1992 ). В частности, анти-SPARC-антитела также распознают альбондин, но не 18 или gp30, что позволяет предположить, что SPARC и альбондин имеют нативный альбумин-связывающий домен ( Шницер и О, 1992 ). Тем не менее, нет никаких доказательств того, что SPARC опосредует поглощение альбумина в опухоли. Было высказано предположение, что способность SPARC связывать альбумин в интерстиции опухоли усиливает накопление связанных с альбумином лекарств в опухолевом пространстве ( Десаи и др., 2008 , 2009 ). Более того, предварительное клиническое исследование продемонстрировало, что экспрессия SPARC коррелирует с ответом на лечение паклитакселом наночастиц альбумина ( nab- паклитаксел или Abraxane®), причем SPARC-позитивные пациенты имеют лучший клинический результат ( Десаи и др., 2009 ). Однако противоречивые данные на мышиной модели KPfC поставили под сомнение эту гипотезу, поскольку дефицит SPARC не влиял на внутриопухолевые концентрации Abraxane® ( Ниссе и др., 2014 ). Следовательно, необходимы дальнейшие исследования, чтобы подтвердить эту гипотезу, в том числе более крупные клинические испытания с участием большего числа пациентов. В настоящее время, исследование III фазы (NCT00785291), проведенное Национальным институтом рака, оценивает, предсказывает ли экспрессия SPARC в сыворотке ответ пациента на Abraxane®, и это может способствовать нашему пониманию роли SPARC в накоплении альбумина в опухолях.
ВПЧ и кальретикулин
Пять различных альбумин-связывающих белков были идентифицированы на плазматических мембранах линий раковых клеток человека (т.е. Т-клеточный лейкоз CCRF-CEM, меланома MV3 и рак молочной железы MCF7) ( Фрицше и др., 2004 ). Четыре из этих белков были идентифицированы как члены семейства hnRNP, включая hnRNP A2 / B1, hnRNP C1, hnRNP A1 и hnRNP A3, и было обнаружено, что пятый белок является calreticulin ( Фрицше и др., 2004 ). Кальретикулин был впервые описан как эндоплазматический ретикулум-шаперон и кальциевый сигнальный белок, но с тех пор было показано, что он участвует в некоторых клеточных функциях, включая клеточную адгезию, модуляцию взаимодействия тромбоцитов и коллагена (заживление ран) и апоптоз ( Мендлович и Конкони, 2010 ). Функции семейства hnRNP недостаточно хорошо охарактеризованы. Однако большинство членов семейства hnRNP были описаны как ядерные РНК-связывающие белки, вовлеченные в процессинг пре-мРНК, такой как сплайсинг РНК, экспорт и стабильность ( Чоудхури и др., 2010 ). Интересно, что hnRNPs были предложены, чтобы играть роль в канцерогенезе, где их сверхэкспрессия действует как биомаркеры для раннего обнаружения опухолей ( Хан и др., 2013 ). Значение этих результатов в настоящее время неясно, и еще предстоит определить, участвуют ли эти белки в опосредованном альбумином поглощении.
FcRn
FcRn экспрессируется во множестве типов клеток и тканей, включая антигенпрезентирующие клетки, эндотелий сосудов, кишечник, легкие, почки и гематоэнцефалический барьер (BBB) (то есть эндотелий и сосудистое сплетение) ( Рупенян и Акилеш, 2007 ). Этот рецептор защищает альбумин и IgG от деградации, связывая оба белка с высоким сродством только при низком pH (pH <6,5) в кислых эндосомах, предотвращая их деградацию через лизосомальный путь и возвращая их во внеклеточное пространство (pH 7,4) ( Чоудхури и др., 2003 ; Обер и др., 2004 ; Андерсон и др., 2006 ; Андерсен и др., 2012 ). Следовательно, это увеличивает период полураспада сывороточного альбумина ( Чоудхури и др., 2003 ; Андерсон и др., 2006 ; Сарав и др., 2009 ). Роль этого рецептора в поглощении альбумина опухолями остается неясной.
Кубилин и Мегалин
Кубилин является мультилигандным рецептором, который наиболее известен своей вовлеченностью в кишечное поглощение комплекса витамина В12 внутреннего фактора ( Зитхарам и др., 1997 ). Более того, было показано, что кубилин участвует в эндоцитозе и трансклеточном транспорте многочисленных лигандов, включая альбумин ( Бирн и др., 2000 ). Кубилин локализуется в абсорбирующих клетках кишечника, плаценте, висцеральных клетках желточного мешка и проксимальных канальцах почек ( Кристенсен и Бирн, 2002 ). Мегалин - это большой трансмембранный белок, который также связывает альбумин ( Cui et al., 1996 ). Этот белок более широко экспрессируется, чем кубилин, и присутствует в сосудистом сплетении, клетках проксимальных канальцев почек, тиреоцитах и т. Д. (Таблица 1 ) ( Кристенсен и Бирн, 2002 ).
Интересно, что мегалин связывается с кубилином с высокой аффинностью, и было высказано предположение, что мегалин способствует интернализации комплексов кубилин-лиганд в качестве корецептора ( Moestrup et al., 1998 ; Кристенсен и Бирн, 2002 ). Кроме того, кубилин также связывает без амниона, белок, который необходим для экспрессии кубилина на клеточной мембране ( Amsellem et al., 2010 ). Кубилин в сочетании с мегалином играет важную роль в поглощении альбумина (т.е. реабсорбции) проксимальными канальцами почек ( Zhai et al., 2000 ; Amsellem et al., 2010 ). Показано, что дефицит кубилина и / или мегалина у мышей и собак вызывает снижение поглощения альбумина в проксимальных канальцах, что приводит к альбуминурии ( Бирн и др., 2000 ; Amsellem et al., 2010 ). Кроме того, пациенты с синдромом Имерслунда-Грасбека, вызванным мутацией в гене кубилина, в целом страдают от протеинурии, демонстрируя важность кубилина в реабсорбции белка почками ( Грасбек, 2006 ).
Альбумин как лекарственный препарат в онкологии
Учитывая усиление эффекта проникновения и удержания, а также накопление альбумина в интерстиции опухоли, развитие альбумина как носителя лекарственного средства становится все более важным с точки зрения целевой доставки терапии рака ( Крац, 2008 , 2010 ). Также было предложено, чтобы альбуминовые носители использовали преимущества присутствия альбондина на эндотелии и SPARC в интерстиции опухоли для увеличения накопления лекарств в опухолевом пространстве ( Десаи и др., 2009 ; Крац, 2010 ). Были разработаны различные системы доставки лекарств с альбумином, включая наночастицы альбумина, конъюгаты альбумина с лекарственным средством, производные альбумин-связывающего лекарственного средства и пролекарства (см. Обзоры, см. Крац, 2008 , 2010 ).
Разработка и одобрение на рынке наночастиц альбумина, нагруженных паклитакселом, nab- паклитаксел или Abraxane®, стали крупным прорывом в области разработки носителей альбумина. Abraxane® был первоначально одобрен для клинического использования в Соединенных Штатах в 2005 году ( Кудловиц и Муджа, 2014 ). Эта наночастица альбумина показана для лечения метастатического рака молочной железы после неудачной комбинированной химиотерапии ( Кудловиц и Муджа, 2014 ). Совсем недавно Abraxane® также был описан для лечения первой линии пациентов с метастатической аденокарциномой поджелудочной железы в комбинации с гемцитабином и пациентов с местно-распространенным или метастатическим немелкоклеточным раком легкого в комбинации с карбоплатином ( Кудловиц и Муджа, 2014 ). Абраксан® имеет более высокий терапевтический индекс, чем один паклитаксел, и вводится в более высоких дозах с меньшей токсичностью и большей эффективностью, чем традиционная терапия паклитакселом ( Градишар и др., 2005 ; Socinski et al., 2012 ; Ивамото, 2013 ). Abraxane® в настоящее время все еще подвергается дальнейшей оценке в клинических испытаниях для других опухолей, таких как рак мочевого пузыря (NCT00583349) и множественная миелома (NCT02075021).
Кроме того, альбумин-связывание как общая стратегия улучшения фармакокинетики лекарств также оценивается. Традиционно считается, что связывание лекарственного средства с альбумином снижает уровень свободного лекарственного средства, доступного для проявления его терапевтической активности ( Lancon et al., 2004 ; Vuignier et al., 2010 ). Тем не менее, исследования также продемонстрировали механизмы, с помощью которых альбумин действует для эффективного улучшения терапевтического использования или уменьшения быстрого клиренса ( Деннис и др., 2002 ; Мерло и Ричардсон, 2014 ). Например, экспериментальный противораковый тиосемикарбазон, а именно ди-2-пиридилкетон 4,4-диметил-3-тиосемикарбазон (Dp44mT) ( Мерло и др., 2013а ) было показано, что он усваивается раковыми клетками через предполагаемый носитель / рецептор ( Мерло и др., 2013b ; Мерло и Ричардсон, 2014 ). Интересно, что поглощение, токсичность и апоптотическая активность Dp44mT значительно повышаются в присутствии HSA ( Мерло и Ричардсон, 2014 ). Учитывая, что Dp44mT нацелен на лизосомы, чтобы вызвать апоптоз ( Лавджой и др., 2011 ) и что HSA потенциально подвергается лизосомальному катаболизму в опухолях ( Андерссон и др., 1991 ; Стеле и др., 1997 ) можно предположить, что HSA облегчает доставку Dp44mT в лизосомы, усиливая его противораковое действие ( Мерло и Ричардсон, 2014 ). Хотя исследования еще не определили точный механизм стимулированного HSA процесса поглощения, связывание альбумина может обеспечить преимущество при создании агентов, нацеленных на опухоль, и это требует дальнейшего интенсивного исследования.
Заключение
Альбумин является универсальным и захватывающим белком. Ввиду большого содержания альбумина в сосудистом и интерстициальном пространстве, внутриклеточное распределение альбумина оставалось плохо охарактеризованным в течение многих лет. Возможно, что альбумин в определенных условиях или во время клеточного стресса поглощается нормальными клетками и опухолевыми клетками на низком и высоком уровнях, соответственно, из-за их скорости метаболизма. Точная роль некоторых не полностью охарактеризованных альбумин-связывающих белков (например, hnRNPs и кальретикулина) в обеспечении поглощения альбумина еще предстоит определить. Тем не менее, поиск и характеристика альбумин-связывающих белков, особенно в раковых клетках, представляет значительный интерес в свете развития альбумина как эффективного лекарственного носителя для борьбы с опухолями.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Подтверждения
Анжелика М. Мерло является получателем гранта на раннюю карьеру в университете Сиднея. Де Р. Ричардсон является лауреатом Национального научного совета по здравоохранению и медицине (NHMRC), старшего научного сотрудника и гранта проекта. Данута С. Калиновский является получателем гранта проекта NHMRC (1048972) и стипендии Хелен и Роберта Эллис от Фонда медицинской школы Сиднея Университета Сиднея.
